CLIQUER ICI POUR ACCEDER A L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE PHYSIQUE)
CLIQUER ICI POUR ACCEDER A LA CORRECTION DE L'EPREUVE DE PHYSIQUE ET CHIMIE DU BACCALAUREAT 2012 (FILIERE SCIENCE PHYSIQUE)
exercice expliquant le pile daniel(très important)
Texte : Zn/Zn2+(aq)//Cu2+(aq)/Cu.
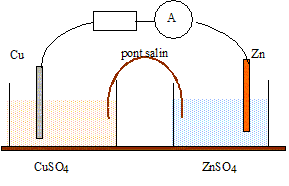
Volume de chaque solution : V= 0,05 L ( 50 mL) ; concentration de chaque solution : C = 0,010 mol/L. Masse de chaque électrode : 3 g
Masse atomique molaire : Zn : 65,4 ; Cu : 63,5 g/mol.
Analyse :
Questions traitant du sens de circulation des porteurs de charges.
Electrons dans les conducteurs métalliques et ions dans les solutions et le pont salin.
Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-.
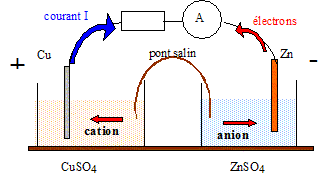
Questions traitant des mots " anode, cathode, oxydation, réduction".
Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-.
Le zinc subit une oxydation ; le zinc constitue l'anode négative.
Les ions Cu2+ se réduisent : Cu2+ +2e- = Cu.
Les ions cuivre (II) subissent une réduction ; le cuivre constitue la cathode positive.
n(Cu2+) =n(Zn2+) =VC = 0,05*0,01 = 5 10-4 mol masse (g) / masse molaire (g/mol) pour le métal des électrodes. n(Cu) = 3/63,5 = 4,72 10-2 mol ; n(Zn) = 3/65,4 = 4,59 10-2 mol ; si Zns est en défaut : 4,6 10-2 -xmax = 0 soit xmax = 4,6 10-2 mol Question traitant de " la pile est usée ". Une pile est usée si le quotient de réaction est égal à la constante d'équilibre de la réaction se produisant dans la pile. Le réactif limitant a presque entierement disparu. Les affirmations contenant l'une des informations ci-dessus sont donc exactes. |
BONNE PREPARATION ET BONNE CHANCE
 22:47
22:47
 Unknown
Unknown

 Posted in
Posted in







0 commentaires :
Enregistrer un commentaire